| 1. | Química y aplicación |
| 2. | Toxicidad |
| 3. | Exposición |
| 4. | Regulación |
| 5. | Referencias |
- Química y aplicación
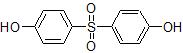
El bisfenol S (BPS, CAS 80-09-1) se compone de dos grupos hidroxifenilo unidos por un grupo sulfonilo y su fórmula química es C12H10O4S (Figura 1). El BPS tiene un volumen de producción previsto entre 1.000 y 10.000 toneladas por año, según la Agencia Europea de Sustancias y Mezclas Químicas (European Chemicals Agency, ECHA 2014). Se utiliza como monómero en polímeros sintéticos tales como polietersulfona (PES) y polisulfona (PSU), así como en resinas epoxi, también se utiliza para el contacto con alimentos (Lotti y col. 2013, Lotti y col. 2011, Liaw 1998 y Gao & Li 2000).
PES ha reemplazado a los policarbonatos basado en bisfenol A (BPA) en los biberones de plástico (Simoneau y col. 2011). En las latas, las resinas epoxy basadas en BPA se han sustituido por BPS (Viñas y col. 2010). Además, el BPS se utiliza en los papeles térmicos (Liao y col. l 2012), y se ha detectado también en el cartón reciclado para alimentos y en el papel de envases de alimentos (Liao y col. 2012).
- Toxicidad
Las investigaciones sobre toxicidad aguda han demostrado LD50 (Lethal dose concentration 50% o dosis letal al 50%) de BPS que van desde 1,6 a > 5 g/kg de peso corporal (pc) (ECHA 2014). De acuerdo con la base da datos de la Agencia Europea de Sustancias y Mezclas Químicas (ECHA), de 10 estudios de genotoxicidad in vitro, todos menos 1 arrojaron resultados negativos. Un estudio reciente revisado por pares mostró evidencias de genotoxicidad en pruebas de inmunofluorescencia y de aberración cromosómica (Lee et al 2009). Dos estudios de dosis repetidas con documentación limitada han notificado un NOAEL (No Observable Adverse Effect Level / nivel sin efecto observable) de 40 a 97 mg/kg de peso corporal/día en criterios de valoración como nefrotoxicidad y aumento de peso corporal (ECHA 2014). En base a dos estudios adicionales de dosis repetidas, la Agencia de Protección Ambiental de EEUU (EPA) concluyó que el BPS tiene un alto potencial de riesgo cuando se utiliza como alternativa a la tinta de impresión. De acuerdo con la ECHA, se ha llevado a cabo un estudio con documentación limitada sobre la toxicidad reproductiva y en el desarrollo; dicho estudio refiere unos Niveles Sin Efecto Adverso Observado (NOAEL) de 60 mg/kg de peso corporal/día para la toxicidad reproductiva (ECHA 2014). En cuanto a las propiedades de alteración endocrina, se considera que el BPA y el BPS tienen una potencia estrogénica comparable (Grignard y col. 2012, Kuruto-Niwa y col. 2005). Ambos muestran una afinidad de unión a receptores de estrógenos mucho menor que el estradiol. Análisis in vitro indicaron que el BPS es un activador de ambos receptores humanos de estrógeno (ER) y un antagonista débil del receptor de andrógenos (AR), mientras que no se pudo confirmar la interferencia con el receptor X de pregnano (PXR) (Molina-Molina y col. 2013). En células de hipófisis de rata, el BPS, en concentraciones del orden femtomolar a picomolar, interrumpió la señalización celular que afecta a la proliferación celular, la muerte celular y la liberación de prolactina, lo que indica las propiedades carcinógenas del BPS (Viñas y Watson 2013). Las respuestas endocrinas del BPS fueron diferentes y más fuertes en combinación con BPA y nonilfenol (Viñas y Watson 2013).
- Exposición
Un estudio de 2011 en biberones fabricados con polietersulfona con un límite de detección (LOD) de 100 ng/kg, no detectó ninguna migración de BPS (Simoneau y col. 2011). En 2011, investigadores españoles sólo detectaron en los refrescos migración de BPA, pero no de BPS (LOD 5-25 ng/L) (Gallart-Ayala y col. 2011). Otro estudio español detectó BPS en concentraciones de hasta 170 y 35 ng/ml en el sobrenadante y alimentos sólidos envasados en latas recubiertas de epoxy, superando parcialmente el SML especificado CE 10/2011 (Viñas y col. 2010). También se detectó BPS en los alimentos envasados en cartón a niveles de hasta 143 ng/g (Liao y col. 2012), pero mucho menos frecuente y a niveles más bajos en papel en contacto con alimentos (tasa de detección: 8,3%, concentración más alta: 12 ng/g). En un estudio de incidencia sobre bisfenoles realizada en China (2012) y en los EEUU (2008-2012), se detectó BPS en aproximadamente el 20% de las muestras en ambos países (Liao y Kannan 2013a, Liao y Kannan 2013b). El BPS supuso menos del 10% de la exposición global al bisfenol tanto en China como en EEUU. Las mayores concentraciones se detectaron en la carne y en productos cárnicos. Los alimentos enlatados tenían las concentraciones medias más significativas (Liao y Kannan 2013a, Liao y Kannan 2013b). Según un estudio de biomonitorización realizado en los EE.UU. y en varios países de Asia, la presencia del BPS era ubicua en las muestras procedentes de Japón y Vietnam; las concentraciones más altas se encontraron en la orina de Japón, seguido por los EE.UU. y China. En base a una sencilla aproximación farmacocinética, se calculó que la ingesta diaria estimada (SEDA) de BPS es de 3.47, 1.48, 0.707 µg/persona/día para Japón, los EE.UU. y China, respectivamente (Liao y col. 2012). Además, se encontró BPS en los sedimentos de las áreas industrializadas en los EE.UU., Japón y Corea, llegando a casi 2 mg/g de peso seco en (Liao y col. 2012). Junto con el BPA, el BPS representó el 90% de todas las concentraciones de bisfenol en los sedimentos. El BPS es menos degradable ambientalmente que otros bisfenoles; sólo se ha logrado su degradación bajo condiciones específicas; (Danzl y col. 2009, Sakai y col. 2007, Ike y col. 2006, Ogata y col. l 2012, Toyama y col. 2013, Cao y col. 2013). Los niveles de BPS en estudios de biomonitorización y en sedimentos pueden aumentar aún más en los próximos años debido a la sustitución del BPA con BPS.
- Regulación
Según el Reglamento Europeo CE 10/2011 el BPA está autorizado para su uso como monómero en artículos en contacto con alimentos de plástico con un límite de migración específica de 0,05 mg/kg de alimento. El SML (Specific Migration Limit o límite de migración específica) no se basa en la evaluación toxicológica, sino más bien en las bajas tasas de migración de BPS. De acuerdo con el informe de 2011 del “Scientific Cooperation Working Group” (ESCO WG) de la Autoridad Europea de Seguridad Alimentaria (EFSA), en los estados miembros de la Unión Europea no existe ninguna legislación nacional sobre el BPS. En los EEUU, el BPS está autorizado como aditivo alimentario indirecto para ser utilizado como monómero en la producción de resinas de polietersulfona para uso repetido. El Código Federal de Regulación no tiene ninguna regulación específica sobre el (CFR, Título 21, Sec.177.2440).
Leer más
El dossier completo en el que se basa este artículo puede ser recuperado como archivo pdf (en inglés).
5. Referencias
Cao, GP. et al. (2013). “Photolysis of bisphenol S in aqueous solutions and the effects of different surfactants.” React Kinet Mech Cat 109:259-71.
Danzl, E.et al. (2009). “Biodegradation of bisphenol A, bisphenol F and bisphenol S in seawater.” Int J Environ Res Public Health 6:1472-84.
ECHA. “Bisphenol S Registration data.” Retrieved January 31, 2014.
Gallart-Ayala, H. et al. (2011). “Analysis of bisphenols in soft drinks by on-line solid phase extraction fast liquid chromatography-tandem mass spectrometry.” Anal Chim Acta 683:227-33.
Gao, J.G. and Li, Y.F. (2000). “Curing kinetics and thermal property characterization of a bisphenol-S epoxy resin and DDS system.” Polym Int 49:1590-5.
Grignard, E. et al. (2012). “Weak estrogenic transcriptional activities of Bisphenol A and Bisphenol S.” Toxicol In Vitro 26:727-31.
Ike, M. et al. (2006). “Biodegradation of a variety of bisphenols under aerobic and anaerobic conditions.” Water Sci Technol 53:153-9.
Kuruto-Niwa, R. et al. (2005). “Estrogenic activity of alkylphenols, bisphenol S, and their chlorinated derivatives using a GFP expression system.” Environ Toxicol Pharmacol. 19:121-30.
Lee, S. et al. (2013). “Genotoxic potentials and related mechanisms of bisphenol A and other bisphenol compounds: a comparison study employing chicken DT40 cells.” Chemosphere. 93:434-40.
Liao C, et al. (2012). “Bisphenol S, a new bisphenol analogue, in paper products and currency bills and its association with bisphenol a residues.” Environ Sci Technol 46:6515-22.
Liao, C. and Kannan, K. (2013a). “A survey of bisphenol A and other bisphenol analogues in foodstuffs from nine cities in China.” Food Addit Contam A.
Liao, C. and Kannan, K. (2013b). “Concentrations and profiles of bisphenol A and other bisphenol analogues in foodstuffs from the United States and their implications for human exposure.” J Agric Food Chem 61:4655-62.
Liao, C. et al. (2012). “Bisphenol analogues in sediments from industrialized areas in the United States, Japan, and Korea: spatial and temporal distributions.” Environ Sci Technol 46:11558-65.
Liao, C. et al. (2012). “Bisphenol S in urine from the United States and seven Asian countries: occurrence and human exposures.” Environ Sci Technol 46:6860-6.
Liaw, D.J. (1998). “Synthesis and properties of polyurethanes based on bisphenol-S derivatives.”Polymer 39:3529-35.
Lotti, N. et al. (2011). « Poly(butylene terephthalate) modified with ethoxylated bisphenol S with increased glass transition temperature and improved thermal stability.” Polymer 52:904-11.
Lotti, N. et al. (2013). “Poly(ethylene terephthalate), modified with bisphenol S units, with increased glass transition temperature.” J Appl Polym Sci 128:416-23.
Molina-Molina, J.M. et al. (2013). “In vitro study on the agonistic and antagonistic activities of bisphenol-S and other bisphenol-A congeners and derivatives via nuclear receptors.” Toxicol Appl Pharmacol. 272:127-36.
Ogata, Y. et al. (2012). “The 4-tert-butylphenol-utilizing bacterium Sphingobium fuliginis OMI can degrade bisphenols via phenolic ring hydroxylation and meta-cleavage pathway.” Environ Sci Technol 47:1017-23.
Sakai, K. et al. (2007). “Biodegradation of bisphenol A and related compounds by Sphingomonassp. strain BP-7 isolated from seawater.” Biosci Biotechnol Biochem. 71:51-7.
Simoneau, C. et al. (2011). “Comparison of migration from polyethersulphone and polycarbonate baby bottles.” Food Addit Contam A 28:1763-8.
Toyama, T. et al. (2013). “Sustainable biodegradation of phenolic endocrine-disrupting chemicals by Phragmites australis-rhizosphere bacteria association.” Water Sci Technol 68:522-9.
Viñas, R. and Watson, C.S. (2013). “Mixtures of xenoestrogens disrupt estradiol-induced non-genomic signaling and downstream functions in pituitary cells.” Environ Health. 26:1-11.
Viñas, R. et al. (2010). “Comparison of two derivatization-based methods for solid-phase microextraction-gas chromatography-mass spectrometric determination of bisphenol A, bisphenol S and biphenol migrated from food cans.” Anal Bioanal Chem 397:115-25.